Вопросы для подготовки к зачету по теме "Основы молекулярной физики и термодинамика"
14. Основные положения МКТ. Диффузия и броуновское движение.
15. Размеры и масса молекул. Количество вещества. Молярная масса. Число Авогадро.
16. Идеальный газ, его основные свойства. Давление газа, единицы давления.
17. Парообразование и конденсация. Испарение. Кипение.
18. Насыщенный пар и его свойства. Влажность воздуха и ее измерение.
19. Поверхностное натяжение жидкости. Коэффициент поверхностного натяжения жидкости. Явления смачивания и не смачивания. Краевой угол.
20. Понятия кристаллического и аморфного тел. Виды кристаллических решёток. Плавление и кристаллизация твёрдых тел.
Ответы.
Часть 1. Основные физические величины, единицы их измерения, формулы для нахождения.
|
Наименование |
Обозначения |
Единицы измерения в СИ |
Формулы |
|
Атомная единица массы |
а.е.м. |
- |
1/12 массы атома углерода=1,66·10-27кг |
|
Количество вещества |
ν ("ню") |
моль |
|
|
Молярная масса |
M |
кг/моль (килограмм на моль) |
M=m0·NA |
|
Число Авогадро |
NA |
моль |
NA=6,02·1023 |
|
Давление |
p | Па (паскаль) | p = F/S |
|
Основное уравнение МКТ |
p | Па (паскаль) | p = 1/3·m0·n·v2 |
| Объединенный газовый закон | p | Па (паскаль) |
p = n·k·T |
| Уравнение Менделеева-Клапейрона | - | - | |
|
Количество теплоты при парообразовании |
Q |
Дж (джоуль) | Q=L·m |
|
Относительная влажность |
φ |
% |
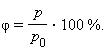 |
|
Количество теплоты при плавлении |
Q | Дж (джоуль) | Q=λ·m |
|
Коэффициент поверхностного натяжения жидкости |
σ | Дж/м2 или Н/м (джоуль на метр в квадрате, ньютон на метр ) |
Часть 2. Основные понятия.
- Все тела состоят из мельчайших частиц – атомов, молекул, между которыми есть промежутки. Строение любого вещества дискретно (прерывисто).
- Атомы и молекулы вещества находятся в непрерывном хаотическом движении.
- Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Диффузией называют явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого. Т.е. это самопроизвольное перемешивание веществ.
Броуновское движение - тепловое движение взвешенных в жидкости (или газе) частиц.
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1*10-8 см = 1*10-10 м
Порядок величины объёма молекулы 1*10-20 м3
Порядок величины массы молекул 1*10-23 г = 1*10-26кг
Количество вещества ע – это физическая величина, показывающая, во сколько раз число молекул в данном веществе больше, чем число атомов в 12 г углерода. Оно равно отношению числа молекул (атомов) (N) в данном макроскопическом теле к числу молекул в 12 г углерода (NA)
![]()
Единица измерения - 1 моль
Молярная масса - масса вещества, взятого в количестве 1 моль.
M=m0·NA
Единица измерения - 1 кг/моль.
Значение молярной массы для каждого элемента можно узнать в таблице Менделеева.
Один моль любого вещества содержит одинаковое число молекул.
Постоянная Авогадро - число молекул в 1 моле любого вещества.
NA =6, 02 * 1023моль -1
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения между молекулами стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул происходит по законам Ньютона.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Парообразование - переход вещества из жидкого состояния в газообразное.
Происходит двумя путями: испарением и кипением.
Конденсация - переход вещества из газообразного состояния в жидкое.
Для того, чтобы превратить в пар при неизменной температуре жидкость массой m, ей необходимо сообщить количество теплоты, равное Qп = L·m
L – удельная теплота парообразования
При конденсации выделяется количество теплоты, равное Qк = - L·m
Испарение - это парообразование, происходящее со свободной поверхности жидкости.
Скорость испарения зависит:
- от рода жидкости (эфир и вода);
- от площади её свободной поверхности (чем больше площадь, тем быстрее испаряется жидкость – блюдце и стакан);
- от температуры (чем выше температура, тем быстрее испаряется жидкость – лужи зимой и летом);
- от наличия движения воздуха над поверхностью (в ветреную погоду и в безветренную).
Кипение - это парообразование, которое происходит в объеме всей жидкости при постоянной температуре.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным.
Свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n·k·T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
Воздух, содержащий водяной пар, называют влажным.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
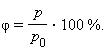
Для измерения влажности воздуха используют приборы гигрометры и психрометры.
Чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил Aвнеш, пропорциональную изменению ΔS площади поверхности:
Aвнеш = σΔS
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0) или просто поверхностным натяжением.
σ = А/ΔS
Коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу.
В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2).
Коэффициент поверхностного натяжения σ зависит
- от рода жидкости;
- от наличия примесей;
- от температуры.
Поверхностное натяжение это физическая величина, равная отношению силы поверхностного натяжения F, приложенной к границе поверхностного слоя жидкости и направленной по касательной к поверхности, к длине L этой границы.
σ = Fк / L
Если капли воды поместить на поверхность чистого стекла, то они будут растекаться, а если на жирную поверхность, то они примут форму, близкую к форме шара.
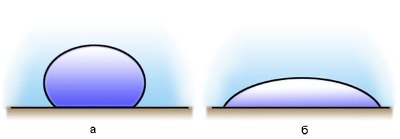
Если силы взаимодействия молекул жидкости с молекулами твердого тела больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. (случай с каплями воды на стекле)
В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом.
Краевой угол – угол между поверхностью твердого тела и касательной к поверхности жидкости в точке соприкосновения.
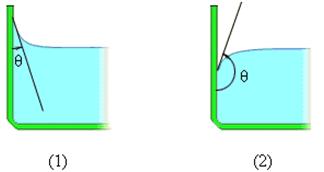
Краевые углы смачивающей (1) и несмачивающей (2) жидкостей.
Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то жидкость не смачивает поверхность твердого тела. (случай с каплями воды на жирной поверхности, ртутью на стекле)
В этом случае краевой угол θ оказывается тупым (рис. 1).
При смачивании θ < 0 (острый), при несмачивании θ > 0 (тупой). При полном смачивании θ = 0, при полном несмачиванииθ = 180°.
Твёрдые тела - вещества, длительное время сохраняющие свою форму и объём.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – кристаллические и аморфные тела.
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества.
Молекулы и атомы в аморфных телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Для аморфных тел, как и для жидкостей, характерен ближний порядок в расположении частиц, но, в отличие от жидкостей, подвижность частиц мала. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), воск, смола, пластики и т. д.
В зависимости от характера сил взаимодействия и природы частиц, находящихся в узлах кристаллической решетки, различают четыре типа кристаллических решеток.
1. Ионные кристаллы. В узлах кристаллической решетки находятся ионы (положительно и отрицательно заряженные) атомов, которые входят в состав молекулы данного вещества. Связь между ними обусловлена электрическими (кулоновскими) силами взаимодействия (притяжения) между разноименными ионами.
Примером ионной решетки служит кристалл каменной соли NaCl.
2. Атомные кристаллы. В узлах кристаллической решетки находятся нейтральные атомы. Между ними существует ковалентная связь (связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене между этими атомами двумя валентными электронами).
Примером атомных кристаллов являются алмаз, графит, германий, кремний.
3. Молекулярные кристаллы. В узлах кристаллической решетки находятся молекулы, ориентированные определенным образом. Между молекулами действуют силы притяжения, характерные для взаимодействия молекул.
К молекулярным кристаллам относятся нафталин, парафин, сухой лед СО2, лед Н2О.
4. Металлические кристаллы. В узлах кристаллической решетки находятся положительные ионы металла, между которыми движутся свободные (валентные) электроны, образующие электронный газ. Связь в металлических кристаллах обеспечивается силами притяжения между положительными ионами, находящимися в узлах решетки, и отрицательным электронным газом.Эти силы притяжения уравновешиваются силами отталкивания между одноименными ионами.
Плавление – переход вещества из твердого состояния в жидкое.
При плавлении температура тела остается постоянной. Все переданное телу тепло идет на разрушение кристалла.
Чтобы перевести в жидкость твердое тело массой m при температуре плавления, ему надо сообщить количество теплоты
Q = λ m
где λ – удельная теплота плавления.
Кристаллизация (отвердевание) – переход вещества из жидкого состояния в твердое
При кристаллизации происходит выделение количества теплоты
Q = -λ m
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
