1. Силы взаимодействия между молекулами и атомами в телах
{slide=Ответ}
Между молекулами одновременно действуют силы притяжения и отталкивания, называемые молекулярными силами. Это силы электромагнитной природы. Силы, действующие между двумя молекулами, зависят от расстояния между ними. Если расстояние между молекулами увеличивать, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
{/slide}
2. От чего зависит скорость диффузии, испарения, броуновского движения
{slide=Ответ}
Скорость диффузии зависит от рода вещества, от температуры, от агрегатного состояния вещества.
Скорость броуновского движения зависит от температуры, массы броуновской частицы.
Скорость испарения зависит от рода вещества, температуры, площади поверхности, наличия движения воздуха над поверхностью (ветра)
{/slide}
3. Приборы для измерения температуры, давления, влажности
{slide=Ответ}
Для измерения температуры используется термометр.
Для измерения давления используется манометр.
Для измерения влажности используются конденсационный гигрометр, волосной гигрометр, психрометр.
{/slide}
4. Фазовые переходы (парообразование, плавление, сублимация, конденсация, кристаллизация)
{slide=Ответ}
Плавление - процесс перехода вещества из твердого состояния в жидкое.
Кристаллизация - процесс перехода вещества из жидкого состояния в твердое.
Сублимация - процесс перехода вещества из твердого состояния с газообразное.
Парообразование - процесс перехода вещества из жидкого состояния в газообразное.
Конденсация - процесс перехода вещества из газообразного состояния в жидкое.
{/slide}
5. Насыщенный, ненасыщенный пар, динамическое равновесие
{slide=Ответ}
Насыщенный пар - пар, находящийся в динамическом равновесии со своей жидкостью.
Ненасыщенный пар - пар, который не достиг динамического равновесия со своей жидкостью.
Динамическое равновесие - состояние между жидкостью и её паром при котором количество молекул, покидающих жидкость, равно количеству молекул, возвращающихся в неё.
{/slide}
6. Формулы давления газа, уравнение Клайперона, уравнение Менделеева-Клайперона, связь кинетичеcкой энергии с температурой
{slide=Ответ}
Формула давления газа - объединенный газовый закон - p = nkT
Уравнение Клайперона ![]()
Уравнение Менделеева-Клайперона ![]()
Связь кинетичеcкой энергии с температурой Е = (3/2)kТ
{/slide}
7. Перевод температуры из Цельсия в Кельвина, из Кельвина в Цельсии
{slide=Ответ}
Связь между абсолютной температурой и температурой по шкале Цельсия выражается формулой Т = 273,16 + t , где t – температура в градусах Цельсия.
Чаще пользуются приближенной формулой:
1) для перевода из температуры в Цельсиях в температуру в Кельвинах Т = 273 + t
2) для перевода из температуры в Кельвинах в температуру в Цельсиях t = Т – 273
{/slide}
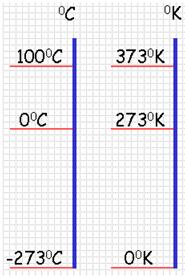
8. Шкала Кельвина, шкала Цельсия
{slide=Ответ}
00 по шкале Цельсия - температура таяния льда.
1000 по шкале Кельвина - температура кипения воды.
00 по шкале Кельвини - абсолютный нуль - температура, при которой должно прекратиться поступательное движение молекул.
шкала Цельсия шкала Кельвина
{/slide}
9. Связь между температурой и давлением газа, между температурой и кинетической энергией молекул газа
{slide=Ответ}
Связь между температурой и давлением газа p=nkT. Между р и Т прямопропорциональная зависимость (во сколько раз увеличивается температура, во столько же раз увеличивается и давление газа).
Связь между температурой и кинетической энергией молекул газа Е = (3/2)kТ. Между р и Е прямопропорциональная зависимость (во сколько раз увеличивается температура, во столько же раз увеличивается и кинетическая энергия молекул газа)
{/slide}
10. Основные положения МКТ и их опытные обоснования
{slide=Ответ}
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
- Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят еще более мелкие элементарные частицы (электроны, протоны, нейтроны). Строение любого вещества дискретно (прерывисто).
- Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
- Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Эти положения подтверждаются опытным путем.
{/slide}
11. Масса и размеры молекул
{slide=Ответ}
Молекулой называют наименьшую устойчивую частицу данного вещества, обладающую его основными химическими свойствами.
Молекула состоит из ещё более мелких частиц – атомов, которые в свою очередь , состоят из электронов и ядер.
Атомом называют наименьшую частицу данного химического элемента.
Размеры молекул очень малы.
Порядок величины диаметра молекулы 1·10-8 см = 1*10-10 м
Порядок величины объёма молекулы 1·10-20 м3
Порядок величины массы молекул 1·10-23 г = 1·10-26кг
{/slide}
12. Свойства твердых тел, жидкостей, газов
{slide=Ответ}
Твердые тела сохраняют объем, сохраняют форму.
Жидкости сохраняют объем, не сохраняют форму.
Газы не сохраняют объем, не сохраняют форму.
{/slide}
13. С поглощением или выделением тепла происходят фазовые переходы.
{slide=Ответ}
Плавление происходит с поглощением тепла
Кристаллизация происходит с выделением тепла.
Парообразование происходит с поглощением тепла.
Конденсация происходит с выделением тепла.
Сублимация происходит с поглощением тепла
{/slide}
14. Влажность воздуха и точка росы
{slide=Ответ}
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
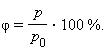
Если воздух не содержит паров воды, то его абсолютная и относительная влажность равны 0.
Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться.
Точка росы – это температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным.
{/slide}
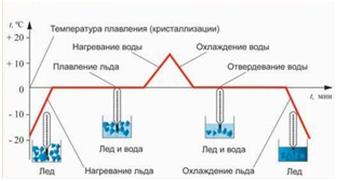
15. График плавления и кипения
{slide=Ответ}
{/slide}
