Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном.
Область, в которой вещество однородно по всем физическим и химическим свойствам, называется фазой состояния этого вещества.
Переход из одного состояния в другое называется фазовым переходом.
Фазовый переход происходит при изменении температуры тела, т.е. при фазовом переходе изменяется внутренняя энергия вещества.

Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Внутреннюю энергию тела можно изменить разными способами:
- Совершение механической работы.
- Теплообмен.
Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются.
Чтобы нагреть тело массой m от температуры t1 до температуры t2 ему необходимо сообщить количество теплоты
Q = cm(t2 – t1)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость.
Переход вещества из жидкого состояния в газообразное называется парообразованием.
Парообразование, происходящее со свободной поверхности жидкости называется испарением.
С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел). Жидкость при испарении охлаждается (ощущение холода при выходе из воды).
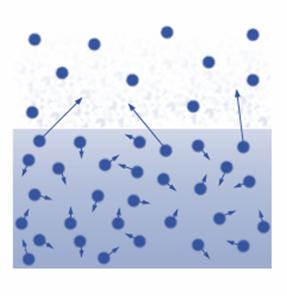
Покинувшие жидкость молекулы составляют пар над её поверхностью. Некоторые молекулы пара при хаотическом движении над поверхностью жидкости залетают обратно в жидкость. Это означает, что наряду с испарением жидкости всегда происходит и конденсация её паров. При конденсации молекулы пара возвращаются в жидкость.
Конденсация – это процесс превращения пара в жидкость.
Скорость испарения зависит:
- от рода жидкости (эфир и вода);
- от площади её свободной поверхности (чем больше площадь, тем быстрее испаряется жидкость – блюдце и стакан);
- от температуры (чем выше температура, тем быстрее испаряется жидкость – лужи зимой и летом);
- от наличия движения воздуха над поверхностью (в ветреную погоду и в безветренную).
На практике для превращения жидкости в пар в процессе теплообмена к ней подводится теплота.
Количество теплоты Qп, необходимое для превращения жидкости в пар при неизменной температуре называется теплотой парообразования.
Для того, чтобы превратить в пар при неизменной температуре жидкость массой m, ей необходимо сообщить количество теплоты, равное Qп = r·m
r – удельная теплота парообразования – количество теплоты, необходимое для превращения в пар
При конденсации выделяется количество теплоты, равное Qк = - r·m
Испарение может происходить не только с поверхности, но и в объеме жидкости.
В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением.
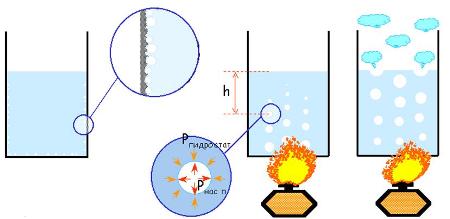
Кипением называют парообразование, которое происходит в объеме всей жидкости при постоянной температуре.
Кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
Каждая жидкость при нормальных условиях кипит при определенной температуре, которая называется температура кипения. Она остается постоянной при одном и том же давлении.
Вещество существует в твердом кристаллическом состоянии при определенных значениях давления и температуры. В этом состоянии вещество находится до тех пор, пока кинетической энергии атомов недостаточно, чтобы преодолеть силы взаимного притяжения. Эти силы удерживают атомы на некотором расстоянии друг относительно друга, не позволяя им перемещаться. При этом атом колеблется около положения своего равновесия. При нагревании твердого тела кинетическая энергия атомов или молекул возрастает. При этом амплитуды колебаний могут стать настолько большими, что уже будут сравнимы с периодом решетки, произойдет нарушение дальнего порядка, кристаллическая решетка начнет разрушаться. При дальнейшем увеличении температуры происходит плавление твердых тел.
Плавление – переход вещества из твердого состояния в жидкое.
При плавлении температура тела остается постоянной. Все переданное телу тепло идет на разрушение кристалла. При плавлении кристаллическое тело находится одновременно в твердом и жидком состояниях.
После разрушения кристалла и образования жидкости подводимая теплота идет на нагревание жидкости.
Температура плавления зависит от рода кристаллического тела.
При плавлении изменяется плотность и объем вещества. У большинства веществ объем при плавлении увеличивается, а при отвердевании уменьшается. При этом изменяется и плотность: при плавлении плотность уменьшается, а при отвердевании увеличивается. Например, кристаллики твердого нафталина или парафина тонут в расплавленном нафталине (парафине).
Но лед плавает в воде. Также ведут себя висмут, галлий, германий, кремний, чугун, т.е. при плавлении их плотность увеличивается, а при отвердевании уменьшается. При плавлении они сжимаются (объем уменьшается), а при отвердевании расширяются (объем увеличивается).
Температура плавления зависит от атмосферного давления.
В тех случаях, когда объем вещества при плавлении возрастает, увеличение внешнего давления приводит к увеличению температуры плавления (т.к. увеличение давления затрудняет процесс плавления). Если же объем вещества при плавлении уменьшается, то увеличение внешнего давления ведет к понижению температуры плавления этого вещества (т.к. повышенное давление помогает процессу плавления в данном случае).
Чтобы перевести в жидкость твердое тело массой m при температуре плавления, ему надо сообщить количество теплоты
Q = λ m
где λ – удельная теплота плавления – количество теплоты, необходимое, чтобы перевести в жидкость твердое тело массой
λ = Q / m [ Дж/кг ]
При плавлении увеличивается внутренняя энергия тела.
Если получившуюся при плавлении жидкость охладить до температуры плавления, то начнется обратный процесс.
Кристаллизация (отвердевание) – процесс перехода жидкости в твердое состояние.
Происходит сближение частиц жидкости и упорядочение их движения, в результате которого они начинают колебаться около узлов кристаллической решетки. Потенциальная энергия молекул при этом уменьшается, а т.к. температура кристаллизации постоянна (равна температуре плавления для данного вещества), процесс кристаллизации должен сопровождаться выделением тепла.
Процесс кристаллизации сопровождается выделением теплоты кристаллизации, которая равна теплоте плавления Q = λ m
Процесс кристаллизации происходит в двухфазной системе вблизи центров кристаллизации. такими центрами могут быть пылинки, мельчайшие примеси.
Процессы плавления и кристаллизации можно представить на графике:
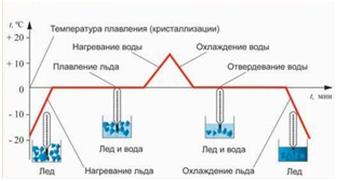
По графику можно определить:
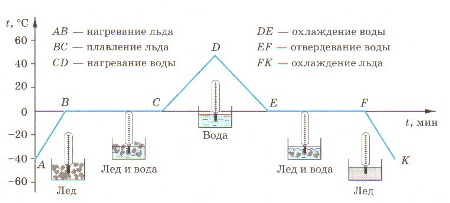
- участок АВ – нагревание льда от -40 0С до температуры плавления 0 0С
- участок ВС – плавление льда при температуре плавления
- участок СD – нагревание воды от 0 0С до температуры 50 0С
- участок DE – охлаждение воды от 50 0С до температуры кристаллизации (отвердевания) 0 0С
- участок EF – кристаллизация (отвердевание) воды при температуре плавления (кристаллизации)
- участок FK – охлаждение льда от 0 0С до температуры -40 0С
Многие твердые вещества обладают запахом – камфара, нафталин. Значит пары этих веществ есть в воздухе. Это доказывает, что при определенных условиях твердые вещества могут переходить из твердого состояния в газообразное, минуя жидкое.
Переход твердого состояния вещества в газообразное называется сублимацией или возгонкой («сублимаре» - возносить)
Легко обнаружить возгонку (сублимацию) льда и снега: уменьшение инея на деревьях со временем, высыхание оледеневшего белья зимой.
Часто можно наблюдать и обратный переход из газообразного состояния непосредственно в твердое, минуя жидкое состояние – десублимация. На окнах зимой иногда можно видеть быстрый рост кристалликов льда в виде узоров на стеклах, которые образуются непосредственно из водяных паров, находящихся в воздухе.
Испарение твердых тел аналогично испарению жидкостей. Все твердые тела испаряются, но их паров обычно так мало, что их невозможно обнаружить. Процесс сублимации происходит как при нагревании твердого тела, так и без подвода теплоты извне. При сублимации происходит охлаждение тела, т.к. его покидают наиболее быстрые молекулы (обладающие кинетической энергией, достаточной для преодоления молекулярного притяжения и отрыва молекул от поверхности тела).
Процесс сублимации или возгонки наблюдается во Вселенной. При сближении с солнцем происходит возгонка поверхностного слоя ядер комет. Практически вся масса кометы сосредоточена в ядре, которое является единственной твердой частью кометы. Ядро кометы состоит из смеси пылинок, твердых кусочков вещества и замерзших газов (углекислый газ, аммиак, метан). В далеких от Солнца областях кометы не имеют хвостов. При приближении кометы к Солнцу ядро прогревается и из него выделяются газы и пыль. Они образуют вокруг ядра газовую оболочку, которая вместе с ядром составляет голову кометы. Газы и пыль, выбрасываемые в голову кометы, отталкиваются под действия давления солнечного света и создают хвост кометы, всегда направленный в сторону, противоположную Солнцу. Чем ближе к Солнцу подходит комета, тем она ярче и тем длиннее её хвост вследствие большего её облучения и интенсивного выделения газов.
